
Во всем мире, в том числе и в России, фиксируется все больше случаев заболевания раком. Это связано с несколькими обстоятельствами – совершенствованием систем диагностики, увеличением средней продолжительности жизни (люди стали доживать до рака) и влиянием канцерогенных факторов. Новообразования становятся причиной примерно 15% всех смертей (чуть чаще у мужчин, чем у женщин). Среди различных диагностируемых онкологических заболеваний наиболее распространены (в порядке убывания): рак кожи, молочной железы, органов дыхания, желудка, ободочной кишки, предстательной железы, колоректальный рак и так далее.
История применения меченных радиоактивными атомами молекул в биологических исследованиях началась в 1913-м с работы Георга Хевеши (Нобелевская премия по химии 1943 года). В 1951-м Бенедикт Кассен с коллегами создал для целей диагностики первый в мире сканер, ставший на десятилетия главным инструментом медицинского применения радиоактивных атомов. Любопытно, что гипотезы о возможности терапевтического использования радиации высказывались еще раньше – в начале ХХ века радий пытались применять для лечения кожного туберкулеза, а в 1903-м Александр Белл предложил использовать радий для лечения опухолей.
С тех пор методы ядерной медицины стали широко применяться в рутинной медицинской практике как для диагностики, так и для терапии онкологических заболеваний. В основе ядерной медицины лежит введение в организм безопасных доз различных биологически активных соединений, которые проявляют специфичность по отношению к той или иной патологии (в том числе опухоли), что приводит к их накоплению в этих патологиях. Такими специфичными молекулами могут быть низкомолекулярные соединения (малые молекулы), пептиды, антитела или их части, белки и пр. В отличие от обычных медицинских препаратов, в состав радиофармацевтического препарата (РФП) входит тот или иной радиоактивный нуклид (радионуклид). В диагностических процедурах радионуклид играет роль радиоактивной метки, в терапии его излучение поражает злокачественные новообразования – то есть фактически речь идет о лучевой терапии (внутри организма) с очень высокой локализацией. Применимость того или иного радионуклида определяется его ядерно-физическими свойствами: типом радиоактивного распада, энергией частиц или квантов и периодом полураспада (используют радионуклиды, чей диапазон периода полураспада составляет от нескольких минут до нескольких дней).
[caption id="attachment_1690722" align="alignright" width="375"] Венгерский радиохимик, лауреат Нобелевской премии по химии Георг Хевеши[/caption]
В диагностике используют регистрацию излучения, испускаемого радионуклидом в составе РФП после его введения в тело пациента, сканируя его целиком или отдельные его участки. Самые распространенные методы – однофотонная компьютерная томография (ОФЭКТ) или позитронно-эмиссионная томография (ПЭТ), которые всегда комбинируют с компьютерной томографией (КТ), используемой для создания анатомического изображения тела пациента. Таким образом получают два изображения – распределение РФП, наложенное на изображение внутренних органов пациента. Для того чтобы понять, насколько использование тех или иных диагностических процедур в ядерной медицине стало рутинной медицинской практикой, можно привести статистику – в развитых странах один ПЭТ-КТ сканер приходится на 600 000 человек.
Одним из самых часто используемых в ОФЭКТ радионуклидов является технеций-99м, получаемый из его материнского радионуклида молибден-99, который, в свою очередь, нарабатывается в больших количествах на исследовательских реакторах. Среди ПЭТ радионуклидов наибольшее распространение получил фтор-18. Он легко может быть наработан в больших количествах на циклотронах (ускорителях заряженных частиц) и введен в структуру тех или иных молекул. Чаще всего в медицинской практике используют фтордезоксиглюкозу (ФДГ), меченную фтором-18. Впервые ее применили в 1976 году.
Наиболее интенсивно развивающаяся сфера ядерной медицины связана с лечением злокачественных новообразований. Терапевтические процедуры могут применяться как самостоятельно, так и в сочетании с другими методами лечения. Ядерная медицина позволяет поражать раковые клетки, минимально затрагивая здоровые ткани, в этом ее принципиальное отличие от лучевой терапии. Избирательное облучение раковых клеток достигается за счет использования препаратов, накапливающихся в опухоли и содержащих радионуклиды, которые излучают частицы с относительно коротким пробегом. Сейчас используются такие радионуклиды, как йод-131, иттрий-90, лютеций-177 и пр., чей пробег излучения (бета-частицы) составляет до нескольких миллиметров в теле пациента. Это зачастую не позволяет полностью исключить воздействие на соседние здоровые ткани, а энергия излучения расходуется на относительно большой траектории (миллиметры). Значительные перспективы связаны с использованием таких радионуклидов, как актиний-225, висмут-213, радий-223, астат-211, индий-111, йод-125, которые излучают частицы (альфа-частицы или электроны Оже) с существенно меньшим пробегом – от нескольких нанометров до нескольких микрометров. После «доставки» в составе того или иного препарата в клетки опухоли распад этих радионуклидов обеспечивает избирательное поражение раковых клеток.
Примером терапевтического РФП, содержащего лютеций-177, служит Lu–PSMA-617 – препарат на основе простат-специфического мембранного антигена (PSMA), который высоко экспрессируется в метастатическом кастрационно-резистентном раке простаты. Другой пример – радий-223 уже используется для уничтожения метастаз в костях, позволяя продлить жизнь пациентам и уменьшить болевой синдром, что существенно повышает качество жизни этих пациентов. Значительные перспективы создания нового поколения терапевтических РФП связаны с такими альфа-излучающими радионуклидами, как актиний-225 и висмут-213 в составе пептидов или белковых молекул. В России существует технология наработки как актиния-225, так и радия-223 на ускорителях протонов высоких энергий.
Наиболее продвинутый подход заключается в комбинации в одном РФП диагностических и терапевтических свойств – так называемая тераностика (пия+диаг), позволяющая врачу работать не «вслепую», а сразу отслеживать накопление РФП в опухоли и оценивать эффективность лечения. Это достигается за счет использования в одной и той же молекуле либо одного радионуклида, который может быть использован одновременно для диагностики методами ПЭТ или ОФЭКТ и терапии, либо различных радионуклидов, один из которых диагностический, а другой – терапевтический. Примером может служить использование препарата DOTA-TATE, представляющего собой пептид длиной в восемь аминокислот с молекулярным фрагментом для удержания радионуклида, который содержит галлий-68 для ПЭТ и лютеций-177 для терапии нейроэндокринных опухолей.
[embed]https://profile.ru/scitech/gadanie-na-lekarstvah-chto-proish...[/embed]
Оценки глобального рынка ядерной медицины разнятся, однако, согласно данным, приводимым в различных источниках, он устойчиво растет не менее чем на 12% в год. Мировой рынок ядерной медицины в 2023-м оценивался в $10,2 млрд при прогнозе его неуклонного роста к 2030 году до значений от $22 млрд до $39 млрд. Доля России на этом рынке пока составляет около 1,17 %, что соответствует $119,9 млн в 2023 году при прогнозе роста до $277,3 млн к 2030 году. Важно, что 2/3 роста определяется перспективами регистрации новых терапевтических или тераностических РФП. Для сравнения: рынок диагностических препаратов растет относительно медленно – оценка среднегодового темпа прироста рынка ОФЭКТ процедур с технецием-99м составляет около 3,3%.
Создание новых РФП связано прежде всего с исследованиями и разработками в области биохимии и молекулярной биологии – необходимо продолжать поиск различных высокоспецифичных биологических молекул, обеспечивающих распознавание раковых клеток, а оптимально – проникновение внутрь клеток. Кроме того, развитие ядерной медицины связано с созданием соответствующей сложной инфраструктуры – в первую очередь ускорителей ядерных частиц высоких энергий для наработки перспективных радионуклидов, лабораторных систем для синтеза РФП согласно принятым требованиям.
 НОВОСТИ СЕГОДНЯ
НОВОСТИ СЕГОДНЯ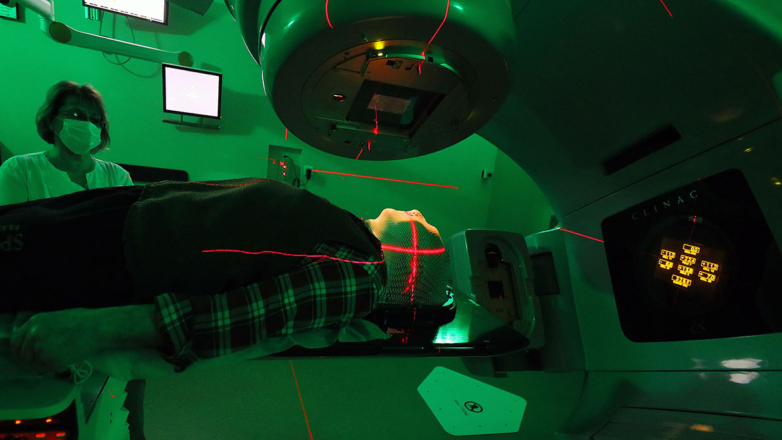
 Похожие новости:
Похожие новости: